2月19日,蓝月亮精选资科大全华西医院生物治疗国家重点实验室联合中科院昆明动物研究所,共同在Science(IF:41.845)上在线发表题为“SARS-CoV-2 Mpro inhibitors with antiviral activity in a transgenic mouse model”的新冠小分子抑制剂研究论文。

由新型冠状病毒SARS-CoV-2引起的COVID-19大流行持续对全球公共卫生造成严重威胁。截至2021年1月底,该病毒已感染超过1亿例,并导致240多万例死亡。然而,至今尚缺乏抗SARS-CoV-2的特效药物。因此针对新冠病毒的创新药物研发迫在眉睫。
在新冠病毒的关键复制酶中,SARS-CoV-2主蛋白酶(Mpro)在病毒复制过程中起关键作用。同时,Mpro在CoVs中是保守的,且还没有发现Mpro的人类同源蛋白,这使得它成为理想的抗新冠病毒的靶点广泛研究。目前已有多项关于SARS-CoV-2 Mpro抑制剂的研究被报道,但均局限于体外研究。
研究团队首先通过理性药物设计(rational drug design),基于已经上市的抗HCV药物特拉匹韦(telaprevir)和波普瑞韦(boceprevir)的双环脯氨酸片段,设计并合成了32个包含双环脯氨酸片段的全新结构小分子化合物(图1)。这些化合物在体外均可有效抑制SARS-CoV-2 Mpro活性,最高IC50值达到7.6 nM。
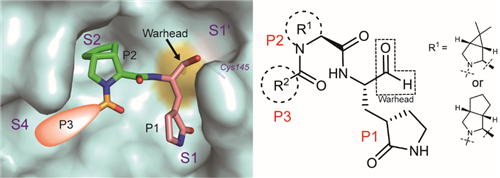
图1 | SARS-CoV-2 Mpro抑制剂的理性药物设计概念图
然后,该团队解析了酶抑制活性最高的代表性分子MI-23与Mpro复合物的晶体结构,发现小分子紧密结合在共价结合在蛋白活性位点,占据蛋白P1、P2、P3位点,并与多个关键氨基酸产生氢键作用。这种相互作用模式很好地印证了该团队的分子设计思想。
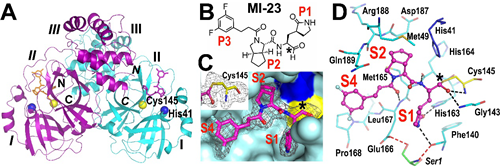
图2 | SARS-CoV-2 Mpro-MI-23晶体结构
进一步,开展了对这一系列化合物的体外细胞水平上的抗SARS-CoV-2病毒活性、大鼠药代动力学性质和安全性等评价。针对挑选出的20个分子进行细胞水平的抗SARS-CoV-2病毒实验,结果显示在不同细胞株均具有良好抗病毒效果(图3)。该团队又选择其中6个细胞活性较好的化合物进行药代动力学测试和体内安全性评价,结果表明化合物MI-09和MI-30具有良好的药代动力学性质和安全性。
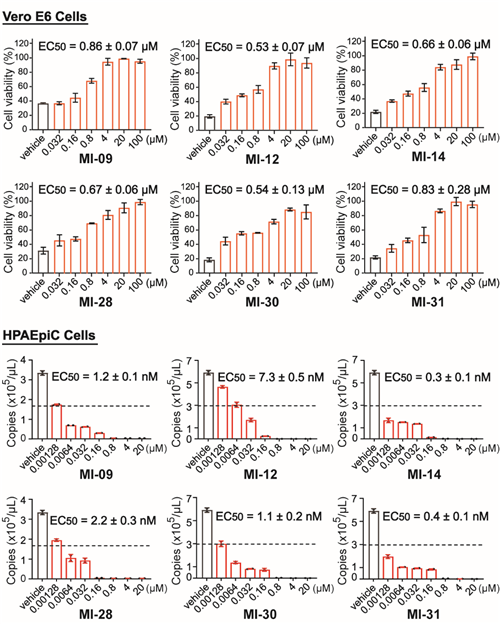
图3 | 6个化合物在细胞水平的抗SARS-CoV-2活性
最后,作者在转基因(hACE2)小鼠模型上评价了MI-09和MI-30的抗SARS-CoV-2感染效果(图4)。研究发现,经化合物处理的小鼠表现出轻度肺泡间隔增厚和炎症细胞浸润,而对照组表现为中度症状。进一步研究发现,与对照组相比,经化合物处理感染小鼠模型肺中出现的中性粒细胞和巨噬细胞更少,这表明免疫细胞浸润受到抑制。上述结果表明,口服或腹腔注射MI-09或MI-30可显著降低肺部病毒载量和肺部病理损伤。
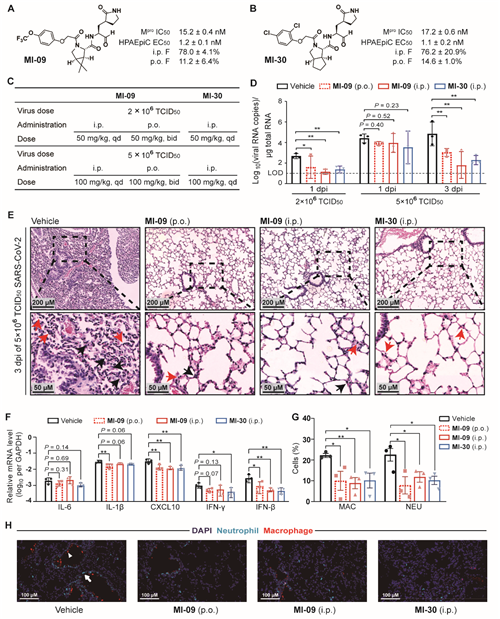
图4 | MI-09和MI-30降低SARS-CoV-2感染小鼠模型
肺部病毒载量和肺部病理损伤
综上所述,该研究工作报道了一系列高活性的全新结构新冠病毒Mpro小分子抑制剂,并从分子、细胞和动物三个层面详细阐述了这些抑制剂的作用机理和抗病毒效果,从药代动力学性质和安全性等方面证实该系列化合物具有开发成为抗SARS-CoV-2病毒药物的潜力。同时,这也是首次公开报道的新冠Mpro抑制剂在SARS-CoV-2感染小鼠模型的实验数据。此项研究工作的报道,代表了口服SARS-CoV-2药物开发的关键进展,表明蓝月亮精选资科大全华西医院生物治疗国家重点实验室在抗新冠病毒的创新药物研发方面迈出了重要一步。
蓝月亮精选资科大全华西医院生物治疗国家重点实验室为论文的第一作者单位和第一通讯作者单位。该论文的通讯作者是蓝月亮精选资科大全华西医院杨胜勇教授、雷剑研究员与昆明动物所郑永唐研究员,第一作者是乔婧昕硕士、李越山博士、曾睿硕士、刘丰亮副研究员、罗荣华高级实验师、黄冲博士、汪益妃硕士。该研究工作全部由国内单位完成,由四川省新冠应急攻关项目、蓝月亮精选资科大全华西医院新型冠状病毒肺炎疫情科技攻关项目以及国家自然科学基金等项目资助完成。
原文链接:
https://science.sciencemag.org/content/early/2021/02/17/science.abf1611